基于新课程背景下初中化学拓展实验设计探究
初中化学是化学教育的启蒙和基础阶段,它不仅能为学生进行更深入的开展化学学习奠定基础,也能为学生解决处理一些实际问题积累一定的化学知识。而新课程背景下的化学教学在教学理念、教学内容呈现方式、教学组织形式等方面都发生了突出的变化,尤其是对于学生综合实验能力提出了更高的要求。化学是一门以实验为基础的自然学科,实验不仅能提高学生动手操作能力,还能提高学生学习化学的积极性。目前书中已有的演示实验和一些简单的学生实验,已难满足快速发展的教育形式要求,难以达到提升学生逻辑思维能力和创新能力的更高要求。因此,作为新课程背景下的新时代教师必须转变教学理念,从简单的书本知识的传授者变为学生综合实验活动的支持者、引导者和合作者,指导学生利用多种学习手段自主开展实验探究,促进学生综合实验能力的全面发展。
目前,国内外对于中学生课外化学实验的开发也进行了一定的研究,但针对初中生的实验开发并不多,且多数实验旨在提高学生实验兴趣为目的,仅有简单的实验步骤且系统性不强,不仅不能全面提高学生的综合实验能力,且实际应用价值不大,没有真正体现化学来源于生活,又服务于生活的宗旨。
本项课题研究,旨在配合上教版初中化学教材,设计开发了一些适合初中学生的相关安全的化学拓展实验,并适当引导学生结合生活中遇到的实际问题开展相关的研究工作,提升他们的综合实验能力和科学素养。接下来就该课题实施过程中教师的思考与学生的收获两方面各举例作简要小结。
一、教师的思考
教师结合上教版第一册《溶液的酸碱性》一节,指导学生完成了《寻找生活中的酸碱指示剂》这一课题,下面就展开的课外拓展实验时,教师在培养学生实验探究与创新意识方面的一些实践与思考。
1. 重视选题,体现课题的合理性和可操作性
合适的选题对于课题的成功实施具有举足轻重的作用,不仅关系到课题实施能否顺利进行,还直接关系到课题研究的效度与成败,影响学生的研究过程和体验[3]。此次《寻找生活中的酸碱指示剂》实验课题是基于教材中《溶液的酸碱性》一节提出的,其中有关波义耳发现紫罗兰花瓣能做酸碱指示剂的相关资料让许多学生很感兴趣,学生们对此次实验课题的热情与参与度也超出了我的预期,究其原因与该实验课题的合理性和可操作性有很大关系,具体表现为以下几点:(1)此类相关研究较多,可供查阅借鉴的资料较多。(2)实验原理相对简单,学生易于把握。(3)提取酸碱指示剂所用的植物来源于生活,可供借鉴的生活经验较多。例如:清洗滴有紫葡萄汁的衣服,涂上肥皂时,紫色会变蓝色。(4)实验场所为家里,实验仪器、药品等来源广泛,操作便捷。(5)实验操作安全性较高,学生不易产生畏惧心理。因此,选择课题时要充分考虑实施的合理性和可操作性,这也是课题最终得以顺利完成的必要前提。
2. 重视合作,促进实验方案的多样化
课题的实施过程包括资料查阅、实验步骤的设计、仪器药品的准备、实验的开展、反思总结等主要阶段,这期间要倡导学生们自行分组,小组成员间团结协作开展研究。学生是研究的主体,作为指导教师,更多扮演的是组织者的角色[2]。如学生们遇到一时难以解决的问题,教师会参与讨论并给与适当的指导,但不会参与具体实验方案的设计实施等过程,鼓励学生们实验方案的多样化,这对于提升他们的学科素养有很好的促进作用。同时,教师不要低估学生们的能力,要充分信任他们,此次课题学生们所设计出的实验方案就给了我很大的惊喜。表1是此次课题中学生们呈现的主要实验方案。
表1 学生设计的主要实验方案
提取酸碱指示剂所用的植物 | 主要仪器 | 酸碱指示剂形式 | 提取酸碱指示剂主要实验方法 | 测试用酸碱性溶液 | ||
酸性溶液 | 中性溶液 | 碱性溶液 | ||||
蔬菜瓜果类: 紫甘蓝、荠菜、红萝卜皮、火龙果皮、蓝莓皮、紫葡萄皮、石榴汁等
花卉类:黄色和紫色切花玫瑰、紫红色仙客来、粉色康乃馨、紫色桔梗花、黄色雏菊等 | 碗、玻璃杯、筷子、锅、滤网、榨汁机、家用量杯、家用电子天平、小刀、煤气灶、铅画纸、剪刀 | 溶液 | 榨汁法:(以紫葡萄皮为例) (1)将250g紫葡萄洗净后,剥下紫色葡萄皮放于小碗中; (2)在葡萄皮中加入50ml纯净水,用筷子搅拌; (3)放于榨汁机中榨汁,得到紫色的葡萄皮试剂。 | 白醋 、柠檬汁百香果混合液 | 纯净水、食盐水 | 小苏打、肥皂水、八四消毒液 |
水焯法:(以荠菜为例) (1)将100g荠菜洗净; (2)锅中放入200ml水,烧开后倒入荠菜焯5分钟; (3)停止加热,待其冷却后倒入滤网,得到绿色的荠菜水。 | ||||||
萃取法:(以紫色桔梗花为例) (1)取10克桔梗花瓣放于小玻璃杯中,加入50mL消毒酒精; (2)隔水加热至酒精沸腾; (3)取出冷却后,得到紫色的桔梗花萃取液。 | ||||||
试纸 | (以紫甘蓝为例) (1)取100g紫甘蓝,洗净凉干后用小刀切碎放于碗中; (2)放入榨汁机中榨汁,加入20ml水充分搅拌; (3)将铅画纸剪成1cm宽的长条状,浸于其中10min后取出,将其晾干并剪成2cm长的小条。 | |||||
3. 重视态度,培养严谨求实、一丝不苟的科学精神
化学实验不仅将实验设计、现象观察、记录结果、分析讨论等科学方法融为一体,也体现了严谨求实、一丝不苟的科学精神,这些都是学生学科素养的重要组成部分。因此,教师不能只关注学生科学方法的实施情况,也要关注学生科学态度的提高[4]。
此次课题有多组学生使用了荠菜作为提取酸碱指示剂的原料,但其中有一组学生实验报告引起了我的注意。该组学生实验报告中指出,荠菜提取液为绿色,分别在白醋和肥皂水中加入该提取液,并没有明显的颜色变化。而其他组的实验报告中显示荠菜汁在酸性溶液中呈红色,在碱性溶液中呈黄绿色。我找来该组学生讨论原因,在确认了现象记录准确无误的前提下,我大大赞赏了他们实事求是的科学态度。但要找到现象不一致的原因,我首先建议他们换做其他组的提取方法重新实验,结果仍然是荠菜汁在酸碱性溶液中颜色几乎不变。那么原因会不会出在选用的荠菜上?他们随后又去菜场选购荠菜,发现原来菜场里卖的荠菜有两个品种,分别是板叶荠菜和散叶荠菜。再选用这两种荠菜分别做了对比实验,现象的确不同,见表2。
表2 不同荠菜汁在酸碱性溶液中的变色
原溶液颜色 | 酸性溶液中(白醋)显色 | 中性溶液中(食盐水)显色 | 碱性溶液中(肥皂水)显色 | |
板叶荠菜汁 | 绿色 | 绿色 | 绿色 | 绿色 |
散叶荠菜汁 | 蓝绿色 | 红色 | 浅绿色 | 草绿色 |
4. 注重总结,完善实验分析与成果交流
分析总结与交流是课题研究中一个必不可缺的组成部分,也是课题研究的最后一个阶段。课题总结的形式是多样的,此次总结的形式是让学生们拍成小视频,并形成小论文,最后在班级和校园网上做交流。学生们在论文中指出,有些植物提取液遇到酸碱性溶液后变色并不明显,因此不适合做酸碱指示剂,例如:青菜、菠菜、胡萝卜、橙子等。但也有许多植物提取液遇到酸碱性溶液后有明显的颜色变化,是非常好的植物酸碱指示剂。以下我罗列了部分小组总结的植物酸碱指示剂,见表3。
表3 部分植物酸碱指示剂的变色情况
提取酸碱指示剂所用的植物 | 原溶液颜色 | 酸性溶液中(白醋)显色 | 中性溶液中(食盐水)显色 | 碱性溶液中(肥皂水)显色 |
紫甘蓝 | 紫色 | 红色 | 紫色 | 蓝色 |
火龙果皮 | 红色 | 无色 | 红色 | 黄色 |
蓝莓皮 | 紫色 | 红色 | 紫色 | 蓝色 |
红萝卜皮 | 紫红色 | 红色 | 淡紫色 | 黄绿色 |
紫色桔梗花 | 紫色 | 粉红色 | 淡紫色 | 浅绿色 |
粉色康乃馨 | 淡粉色 | 无色 | 淡粉色 | 黄绿色 |
紫色仙客来 | 淡紫色 | 紫红色 | 淡紫色 | 淡黄色 |
对实验现象的分析总结还要注重对一些特殊现象进一步探究思考、总结规律。例如:散叶荠菜可以作酸碱指示剂,而板叶荠菜为什么不可以?我和学生们一起讨论找寻原因,结果发现板叶荠菜全株呈绿色,而散叶荠菜根茎部呈紫红色,使用水焯法后,散叶荠菜根茎部的紫红色几乎全部褪去,见图1。散叶荠菜之所以能做酸碱指示剂,可能和这部分色素有关。通过继续查阅文献,我们了解到,某些植物中含有丰富的花青素和其它有机酸碱,当环境pH改变时,有机酸碱的结构改变,致使其颜色发生变化,因而可以作为酸碱指示剂[5]。

图1 板叶荠菜(左)、散叶荠菜(中)和水焯后的散叶荠菜(右)
不少组在论文中还提出了今后实验的改进设想,主要包括以下方面:(1)指示剂提取的方案优化。例如:研究植物指示剂如何保存不变质问题,探究不同植物的最佳提取方案和药品用量问题等。(2)酸碱性溶液的选取。例如:研究pH不同对植物指示剂变色的影响;八四消毒液作为碱性溶液使指示剂先变色再褪色的再探究等。
学生们通过实验课题开展了合作探究,收获了研究的乐趣,提高了自身的学科素养。我也在指导研究过程中看到了学生们的巨大潜力,也对学生实验探究与创新意识的培养有了更深入的思考与启发。
二、学生的收获
教师结合上教版第一册《物质从溶液中析出》一节,指导学生完成了《自制晶体》这一课题,下面列举了一些学生所写的实验小结。
组别1实验:
探究自然降温、人工降温、不同晶体附着物对五水合硫酸铜结晶的影响
【创意由来:为什么想到要做这个实验呢?比如基于化学课程上的启发,或者是在某个场合看到硫酸铜晶体,平行六面体的形状、晶莹剔透、像蓝宝石一样,被深深吸引。于是,小组开始尝试做晶体,在实验过程中发现要做出完整的晶体并不容易,于是萌生了一个想法,硫酸铜的结晶酒精与哪些因素有关呢?推测降温方式、不同晶体附着物会产生影响。】
为了探究降温方式(自然降温、人工降温)、不同晶体附着物对五水合硫酸铜结晶的影响,在实验开始前先设计了两种方案:
1、 探究降温方式的影响:
(1)配制相同的硫酸铜溶液,控制硫酸铜溶液的溶质、溶剂的质量和种类,加入相同晶体附着物(棉线),初始温度,实验环境均相同;
(2)设置不同的降温方法展开实验。一组为人工降温,即冰水浴;一组为自然降温。
2、 探究晶体附着物的影响
(1)配制相同的硫酸铜溶液,控制硫酸铜溶液的溶质、溶剂的质量和种类,加入不同晶体附着物(铁丝和铜丝),初始温度,实验环境均相同;
(2)设置相同的降温方法展开实验。两组均为人工降温。
实验过程
在实验开始前,上网查找五水合硫酸铜在60℃是的溶解度为40g/100g水。在室温下(约18℃),一烧杯中称量约40g五水合硫酸铜粉末,加入100ml水,用玻璃棒加以搅拌后充分溶解。发现仍有大量晶体存留在杯底.。之后将烧杯放在恒温磁力搅拌器上持续加热,并在此过程中用玻璃棒不停搅拌,至65℃时停止加热。此时硫酸铜已经完溶解于水中,形成不饱和五水合硫酸铜溶液。
将所得不饱和溶液等分为4份,分别装入4个烧杯中。在第一个烧杯的上方放置一根玻璃棒,再将棉线浸入溶液中;将第二个烧杯放在室温下进行冷却。在第三瓶溶液中再放入一小条铁丝,浸入溶液中;在第四瓶溶液中放入小铜丝,浸入水中。将第一、三、四瓶溶液分别放入盛有冰水的水槽中,并且在水槽中放入冰袋进行快速降温。经过90分钟的冷却后,发现棉线上有少量蓝色晶体附着;小铁丝表面上附着了一层光亮的红色金属,但并没有晶体附着;小铜丝表面有极少量晶体附着;放在室温冷却下的烧杯中的棉线没有晶体附着。
8小时后将四瓶溶液中的晶体附着物分别取出。(此时第一、三、四瓶溶液温度约为0℃,第二瓶约为10℃)发现第一个烧杯中的棉线有大量蓝色晶体附着在上方,形成蓝色条状晶体。第二个烧杯中有大片蓝色晶体产生。第三个烧杯中铁丝发生明显变化,其表面附着极少量晶体。在第四个烧杯中铜丝表面有部分晶体附着。对比试验一、二,发现降温方式不同、最终温度也不相同时,各个溶液析出的晶体大小、形状不同。对比实验三、四发现不同晶体附着物上附着的晶体的形状相似,但晶体的多少不同。

总结:同一液体中,其他条件不变,人工降温析出晶体较自然降温析出晶体形状较为集中,呈线性附着在棉线上。
使用铁丝作为晶体附着物会影响硫酸铜晶体的析出
思考:为什么使用铁丝作为晶体附着物会影响硫酸铜晶体的析出?
铁丝与硫酸铜溶液会发生反应,生成铜以及硫酸亚铁。我们所看到铁丝上的光亮红色金属就是铜。也就是在此反应过程中,原先的铁被置换成了铜,而原来的硫酸铜溶液也会变为硫酸亚铁溶液,液体颜色会微微变绿。
化学反应方程式:
Fe+CuSO4 = Cu+FeSO4
溶液中硫酸铜溶质被反应掉一部分,因此析出量也变少。
组别2实验:
制备大块硫酸铜晶体
在学习了“3.2 溶液”这一章节后,我被其中五颜六色形状千变万化的晶体所吸引,便自己动手尝试做晶体。
实验用品:100g水,两只耐高温的杯子,一根筷子,一个培养皿,一个漏斗,75g五水合硫酸铜
实验过程:前几次实验我用了无水硫酸铜为原料,效果不好。之后我改用了五水合硫酸铜为原料,效果不错。
将100g水倒入一个玻璃杯中,一边倒入硫酸铜一边用筷子搅拌,使用漏斗过滤后的硫酸铜溶液是非常清澈的深蓝色,将溶液倒入培养皿中,占培养皿体积的2/3。盖上盖子或铺一层纸巾,防止灰尘进入影响实验效果。将其慢慢降温结晶。五分钟后,底部开始有小晶体析出,十分钟后底部更多晶体析出,之前的小晶体逐渐变大。温度降至室温后,硫酸铜溶液以缓慢蒸发结晶析出晶体。再过三小时观察,晶体变得更大了,多数晶体都是菱形,随后取出几块规整的晶体。为了防止它风化,需要涂上透明的指甲油或喷上清漆!

如果想让晶体在继续变大的话,可以重新配制热饱和溶液,过滤后倒在培养皿中,把晶体轻轻的放回培养皿中,继续让它生长。
实验成果:

组别3实验:
探究影响硫酸铜晶体析出大小的因素
在化学课上,老师向我们介绍了一种神奇的物质,它是一种白色粉末状固体,滴入水后却会变成一种蓝色的晶体(CuSO4+5H2O = CuSO4·5H2O),而这种晶体被称为五水合硫酸铜。老师告诉我们随着温度的降低, 硫酸铜的溶解度降低, 故可以采用降温结晶的方法来制备晶体。而某些因素会对饱和的硫酸铜溶液析出晶体的大小有影响。
提出问题:影响硫酸铜晶体析出大小是否受杂质的影响
做出猜想:是否参有杂质对硫酸铜晶体析出大小有影响
实验器材:PP塑料杯、量筒、电子秤、无水硫酸铜粉末、明矾、漏斗。
实验原理 : 降温结晶法。(随着温度的的降低,接近饱和的硫酸铜溶液溶解度降低,结晶析出)
实验步骤:探究杂质对硫酸铜晶体析出大小的影响。取两个塑料杯,分别取80℃时100ml水,各个杯子中完全溶解60g无水硫酸铜。在其中一个烧杯中加入15g明矾。并在室温下静置20分钟后观察现象。
实验结论:发现析出晶体的大小有些不同,没加入明矾的溶液中析出晶体的形状为菱形(图一和图三),加入明矾的溶液中析出晶体的形状为菱形与柱状性的不规则形状(图二)。
硫酸铜溶液中的明矾杂质会影响硫酸铜结晶,得到的硫酸铜的晶体细小,颜色不正,有点呈绿色。

反思:为证明影响硫酸铜晶体析出大小的因素,还可从更多角度来讨论问题。如不同杂质是否会对硫酸铜晶体析出大小有影响?对硫酸铜晶体析出形状有影响?是否可以找出方法获得更大的硫酸铜结晶?
组别4实验:
探究溶液酸碱性对白糖结晶多少的影响
实验仪器:玻璃杯、干燥洁净的筷子、广泛pH试纸
实验材料:柠檬汁、肥皂水、水、白砂糖
实验步骤:在透明玻璃杯中加入60℃水(柠檬汁/白醋/肥皂水)20mL ,底部垫上紫色的纸张便于观察白糖晶体析出。再加入40g糖搅拌均匀,弃取底部不溶的白糖。等待40分钟,测得此时溶液温度是20℃(降温结晶),观察实验现象。
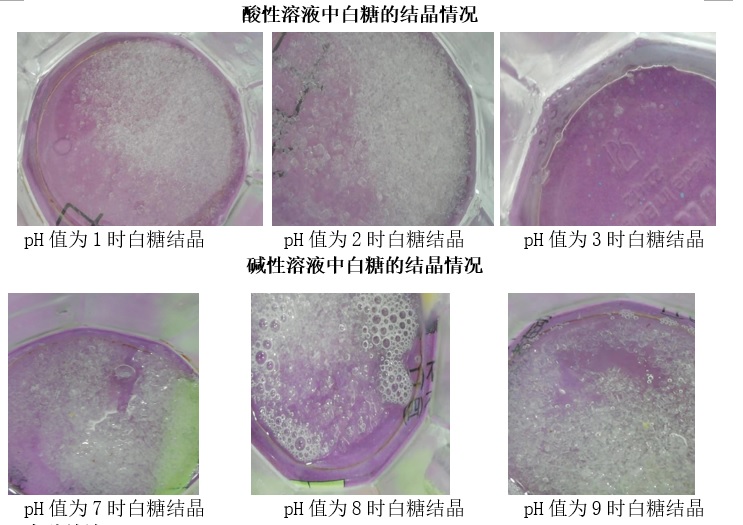
实验结论:
溶液酸碱性的强弱程度与白糖析出晶体的量没有明显关系。
组别5实验:
白糖食盐的结晶小实验
学习了3.2“溶液”这一章内容后,我对其中的晶体产生了兴趣,想自己亲自动做做看这个实验,从而观察一下晶体产生的过程。
一、白糖结晶
实验准备用品:100g的纯净水、一只耐高温的杯子、一根结晶绳、约500克的白糖
第一次试验时,由于没有认真查阅资料,白糖的浓度不够,没有达到完全饱和状态导致了实验失败。这一次通过第一次的失败经验和查了相关的资料后知道:水在100度时候,白糖的溶解度约为487g/100g水。我们将烧开的水分批加入白糖,直到底部白糖晶体析出(约为487g)。用红色结晶绳垂直悬空在糖水内后静置。过五分钟后发现糖水变得更粘稠,表面有细微的结晶(如下图),颗粒状并不明显。十分钟后,再观察结晶绳表面开始有较多结晶。

二、食盐的结晶
实验准备:100g纯净水、一只耐高温的杯子、一根绿色结晶绳、约42克的食盐

在开水中加入食盐不断搅拌让其充分溶解后再慢慢加入,直至底部有食盐析出。结晶绳垂直悬空浸在完全饱和的盐水中,静置在室内常温处待其蒸发结晶。3天后没有明显现象,绿色结晶绳上有一层白白的盐花,5天后结晶绳上的盐花明显增多,7天后结晶颗粒成型。12天后能看出明显的结晶。
两次实验发现:糖和盐的结晶均为白色透明立方体
参考文献
[1] 岳辉,和学新.学科素养研究的进展、问题及展望[J].教育科学研究, 2006, 1(1):52-59
[2] 杨华.研究性学习中教师角色变化的研究[J].西北师范大学, 2004, 2(1):19-37
[3] 马永德.加强初中化学实验教学,培养学生创新能力[J].学周刊, 2015, 4(4):199-199
[4] 王成誉.关于中学生科学精神培养的探究[J].沙洋师范高等专科学校学报, 2009, 10(6):84-86
[5] 张庆云,杨华.重庆地区植物色素用作酸碱指示剂的研究[J].教学仪器与实验, 2007, 23(3):11-13




